前 言
本标准的附录A和资料B为资料性附录。
本标准由中华人民共和国司法部司法鉴定科学技术研究所提出。
本标准由中华人民共和国司法部归口。
本标准起草单位:中华人民共和国司法部司法鉴定科学技术研究所。
本标准主要起草人:向平、卓先义、沈保华、刘伟、卜俊、马栋、严慧。
生物检材中巴比妥类药物的测定
液相色谱-串联质谱法
1 范围
本标准规定了血液、尿液、胃内容物和组织等检材中巴比妥类药物(参见附录 A)的测定方法。
本标准适用于血液、尿液、胃内容物和组织等检材中巴比妥类药物的定性定量分析。
本标准中血液的方法检出限为100ng/mL。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 6682 分析实验室用水规格和试验方法( GB/T 6682-2008, ISO 3696: 1987, MOD)
GA/T 122 毒物分析名词术语
3 原理
本法利用巴比妥类药物在酸性条件下易溶于有机溶剂、难溶于水的特点,用有机溶剂从生物检材中提出,采用液相色谱-串联质谱仪的多反应监测模式进行测定。
4 试剂和材料
除另有规定外,试剂均为分析纯,水为 GB/T 6682 规定的一级水。
4.1 巴比妥类药物对照品
纯度≥99%,参见附录 A。
4.2 乙酰水杨酸对照品
纯度≥99%。
4.3 巴比妥类药物对照品溶液的制备
分别精密称取对照品巴比妥类药物和内标乙酰水杨酸各适量,用甲醇配成1mg/mL的对照品储备溶液,置于-18oC冷冻保存,保存期为1年。试验中所用其它浓度的标准溶液均从上述储备液稀释而得,储存在4℃ 冰箱中,保存期为3个月。
4.4 混合对照品工作溶液
分别取巴比妥类药物储备液混合,用甲醇稀释成10μg/mL的混合对照品工作溶液,储存在4℃ 冰箱中,保存期为3个月。
4.5 乙醚。
4.6 乙腈
色谱纯。
4.7 0.1mol/L 盐酸。
4.8 乙酸胺
色谱纯。
4.9 甲酸
优级纯。
4.10 乙酸胺
色谱纯。
4.11 流动相缓冲液
20mmol/L 乙酸铵和 0.1%甲酸缓冲液:分别称取 1.54g 乙酸铵和 1.84g 甲酸置于 1000mL容量瓶中,加水定容至刻度, pH 值约为 4。
5 仪器
5.1 液相色谱-串联质谱联用仪
配有电喷雾离子源。
5.2 分析天平
感量0.1mg。
5.3 旋涡混合器。
5.4 离心机。
5.5 恒温水浴锅。
5.6 移液器。
5.7 具塞离心试管。
6 测定步骤
6.1 样品预处理
6.1.1 血液或尿液直接提取
取血液或尿液 1mL,加入 1μg 内标乙酰水杨酸,置于 10mL 离心管中,加入2 滴0.1mol/LHCl,加入 3.5mL 乙醚,涡旋混合、离心分层,转移乙醚层至另一离心管中,约60°C水浴中挥干,加入 100μL 乙腈:流动相缓冲液(70: 30)溶解残留物,取 5μL 进 LC-MS/MS。
6.1.2 胃内容物或组织提取称取胃内容物或绞碎的组织(或匀浆) 1g,加入 1μg 内标乙酰水杨酸,以下同 6.1.1 项
下操作。
6.2 测定
6.2.1 液相色谱-串联质谱条件
a) 液相柱: Cosmosil packed 柱(150mm×2.0mm×5μm)或相当者,前接 C18 保护柱;
b) 柱温:室温;
c) 流动相: V(乙腈) : V(缓冲液) = 70 : 30;
d) 流速: 200μL/min;
e) 进样量: 5μL;
f) 扫描方式:负离子扫描(ESI-);
g) 多反应监测(MRM);
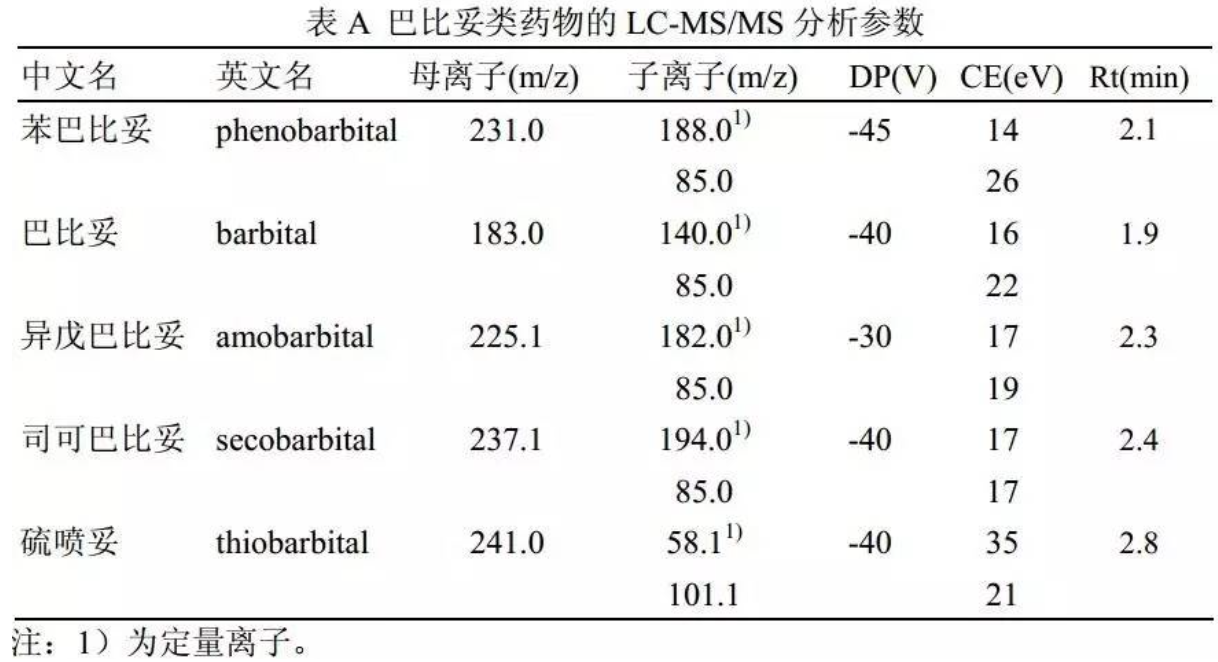
h) 每个化合物分别选择 2 对母离子/子离子对作为定性离子对,以第一对离子对作为定量离子对。其定性离子对、定量离子对、去簇电压(DP)、碰撞能量(CE)和保留时间( tR)见附录 A。
6.2.2 定性测定
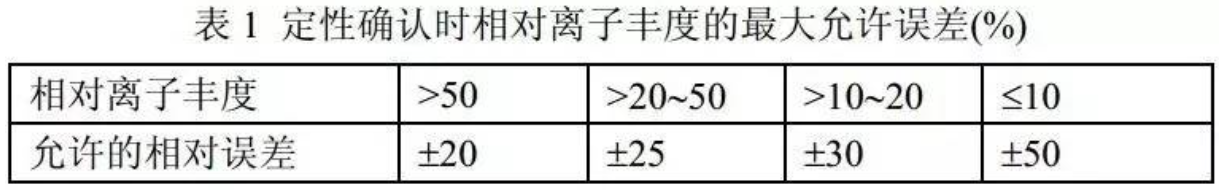
进行样品测定时,如果检出的色谱峰保留时间与空白检材添加对照品的色谱峰保留时间比较,相对误差小于2%,并且在扣除背景后的样品质谱图中,均出现所选择的离子对,而且所选择的离子对相对丰度比与添加对照品的离子对相对丰度比之相对误差不超过表1 规定的范围,则可判断样品中存在这种化合物。
6.2.3 定量测定
采用内标-校准曲线法或单点法定量。用相同基质空白添加适量目标物对照品制得一系列校准样品,以目标物的峰面积与内标峰面积比对目标物浓度绘制校准曲线,并且保证所测样品中目标物的响应值在其线性范围内。当空白检材中添加目标物浓度在检材中目标物浓度的±50% 以内时,可采用单点校准计算检材中目标物浓度。
6.3 平行试验
样品应按以上步骤同时平行测定两份。
平行试验中两份检材测定结果的双样相对相差若不超过 20%时(腐败检材不超过 30%),结果按两份检材浓度的平均值计算。双样相对相差按式(1)计算:
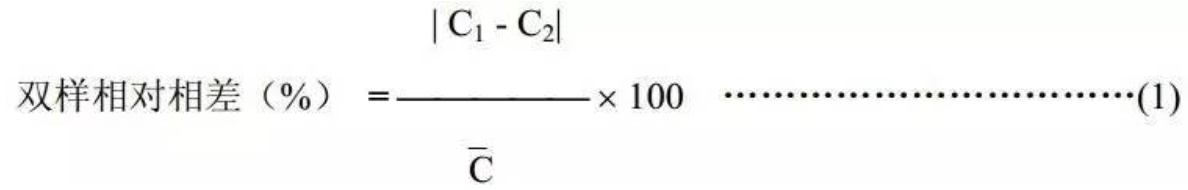
式中:
C1、 C2两份样品平行定量测定的结果;
C 两份样品平行定量测定结果的平均值(C1+C2)/2。
6.4 空白试验
除以相同基质空白替代检材外,均按上述步骤进行。
7 结果计算
以内标-校准曲线法或按式( 2)计算被测样品中巴比妥类药物的浓度:

式中:
C检材中目标物的浓度,单位为微克每毫升或微克每克(μg/mL或μg/g);
A检材中目标物的峰面积;
A′空白检材中添加目标物的峰面积;
Ai′空白检材添加内标物的峰面积;
Ai检材中内标物的峰面积;
c空白检材中添加目标物的浓度,单位为微克每毫升或微克每克(μg/mL或μg/g)。
附 录 A
(资料性附录)
巴比妥类药物的 LC-MS/MS 分析参数
附 录 B
(资料性附录)
5 种巴比妥类药物的 MRM 色谱图

发表评论